2023年4月,窦非教授课题组在Journal of Molecular Biology上发表题为“The phosphorylation status of Hsp82 regulates mitochondrial homeostasis during glucose sensing in Saccharomyces cerevisiae”的研究性文章。2019级博士研究生彭冠族为第一作者,窦非教授和李万杰高级工程师为共同通讯作者。
越来越多的研究表明即使在有氧条件下,很多细胞,如酿酒酵母、肿瘤细胞和神经干细胞等倾向于采用糖酵解而不是氧化磷酸化的代谢方式来分解葡萄糖,为细胞快速分裂或应对应激时合成大量所需原料。这两种代谢方式的转换具有重要的生物学意义。但目前关于代谢转换过程的调控机制尚不明确。近年来,我们实验室以酿酒酵母为研究对象对调控代谢转换的关键分子开展研究。在有氧糖酵解转换为氧化磷酸化代谢方式的双相转换期时,酵母细胞内会发生时间依赖性的基因和蛋白表达的动态变化,线粒体的功能和形态网络也随之发生动态变化以适应氧化磷酸化代谢方式的需求。实验室前期的工作发现,胞外葡萄糖水平通过共分子伴侣Ppt1调控Hsp82 Ser485残基的磷酸化状态来影响Hsp82在细胞质和细胞核之间的动态分布。模拟Hsp82 Ser485残基去磷酸化的Hsp82S485A突变体中Hsp82在细胞质和细胞核之间的动态分布异常。此外,Hsp82S485A突变体具有异常的液泡形态,静息期时细胞直径较小,及无法在葡萄糖饥饿条件下存活等异常特征(Shang X, Cao G, Gao H, et al. A Single Site Phosphorylation on Hsp82 Ensures Cell Survival during Starvation in Saccharomyces cerevisiae [J]. Journal of Molecular Biology, 2020, 432(21): 5809-5824.)。但我们对于Hsp82S485A突变影响了细胞内哪些代谢通路及其分子机制还不清楚,有待进一步探索。
在本研究中,我们发现分子伴侣Hsp82除了参与代谢转换过程中早期诱导的应激反应,Hsp82 Ser485残基的磷酸化状态还调控了代谢转换过程中线粒体的功能和形态结构来维持细胞内线粒体稳态。Hsp82S485A突变表现出与线粒体缺陷相关的异常生长表型,例如小克隆表型、生长速率缓慢和无法利用不可发酵碳源等。进一步探索生长缺陷的原因,我们发现Hsp82S485A突变体导致线粒体功能障碍,包括细胞耗氧率降低、线粒体电子传递链缺陷、线粒体膜电位降低以及线粒体基因组完全丢失。此外,Hsp82S485A突变体线粒体呈断裂状或球状的异常形态,线粒体结构明显肿胀而且线粒体嵴结构缺失,这可能是其线粒体功能障碍的主要原因。通过对野生型菌株和Hsp82S485A菌株的转录组和蛋白质组进行分析和验证后,我们发现Hsp82 Ser485残基的磷酸化状态可能通过影响线粒体裂变和融合相关蛋白的稳定性来调控线粒体功能和形态。该研究为代谢转换过程中从葡萄糖感知到线粒体功能和形态变化的信号通路提供潜在的关键分子。
目前本课题研究已发表了两篇研究性论文和申请了一项发明专利。后续我们将对胞外葡萄糖水平调控Hsp82 Ser485残基磷酸化修饰以及Hsp82调控线粒体稳态的分子机制开展进一步的研究。
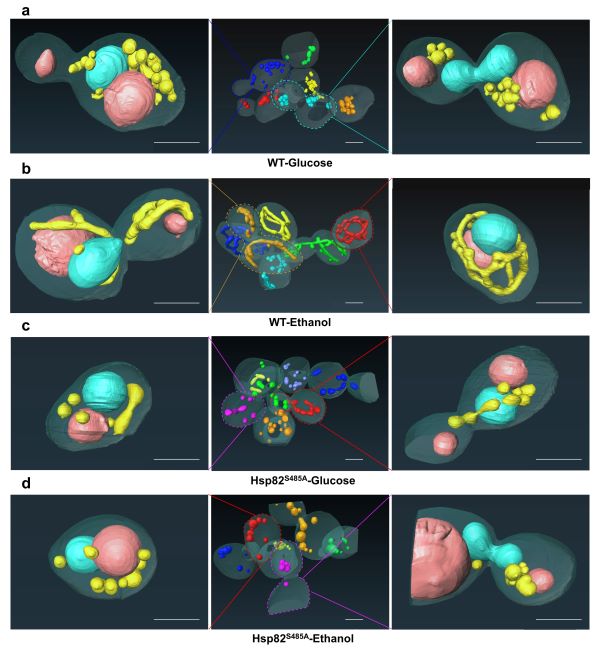
图. 双束扫描电镜三维重构葡萄糖和乙醇条件下野生型和Hsp82S485A突变体酵母细胞。蓝色表示细胞核,藕粉色表示液泡,黄色表示线粒体。Scale bar; 2 µm。
原文链接:https://www.sciencedirect.com/science/article/pii/S0022283623001729