2025年8月16日,北京师范大学生命科学学院张莹教授团队与国家生物信息中心侍骏超研究员、山东大学妇儿与生殖健康研究院颜磊教授合作,在Nature Communications发表研究性论文,揭示宫腔液小RNA是传递母体妊娠早期环境暴露信息的重要载体。

DOHaD(健康与疾病的发育起源)理论由英国流行病学家 David Barker 提出,揭示了生命早期环境对成年健康的深远影响。Barker 对荷兰饥荒的研究发现孕早期经历饥荒相比孕中晚期暴露的母亲所生后代有更严重的心血管与代谢紊乱;英国发育生物学家 Tom P. Fleming 在大鼠早期低蛋白饮食模型中发现子代神经系统、行为及心血管发育出现异常。这些发现都强调了孕早期是影响子代健康的关键窗口。但在分子层面,孕早期母体环境信号如何跨越细胞屏障,影响早期胚胎发育并塑造后代健康,一直是未解之谜。
前期张莹、侍骏超参与的Science研究首次发现精子 tsRNA 可传递父源代谢信号(Science 2016),并于2018 年在 Nature Cell Biology 揭示了 RNA 修饰在其中的关键作用。这些研究建立了“配子小 RNA 介导环境信息传递”的基础框架。基于妊娠建立研究中发现宫腔液体对于早期胚胎发育和妊娠建立的重要调控作用,2017 年他们提出宫腔液可能承载孕早期母体环境信号的非编码小 RNA(Trends in Molecular Medicine 2017),但缺乏直接证据。如今,这一假设终于迎来实验验证。
为了深入揭示小RNA动态表达谱,他们开发了新型小RNA测序平台PANDORA-seq(Nature Cell Biology 2021;Nature Protocols 2025)。这项测序技术突破了传统测序无法检测带修饰小 RNA 的限制,首次让包括 tsRNA 和 rsRNA 在内的大量功能性分子进入视野。这为捕捉母体与胚胎之间的 RNA 信号提供了关键技术保障。
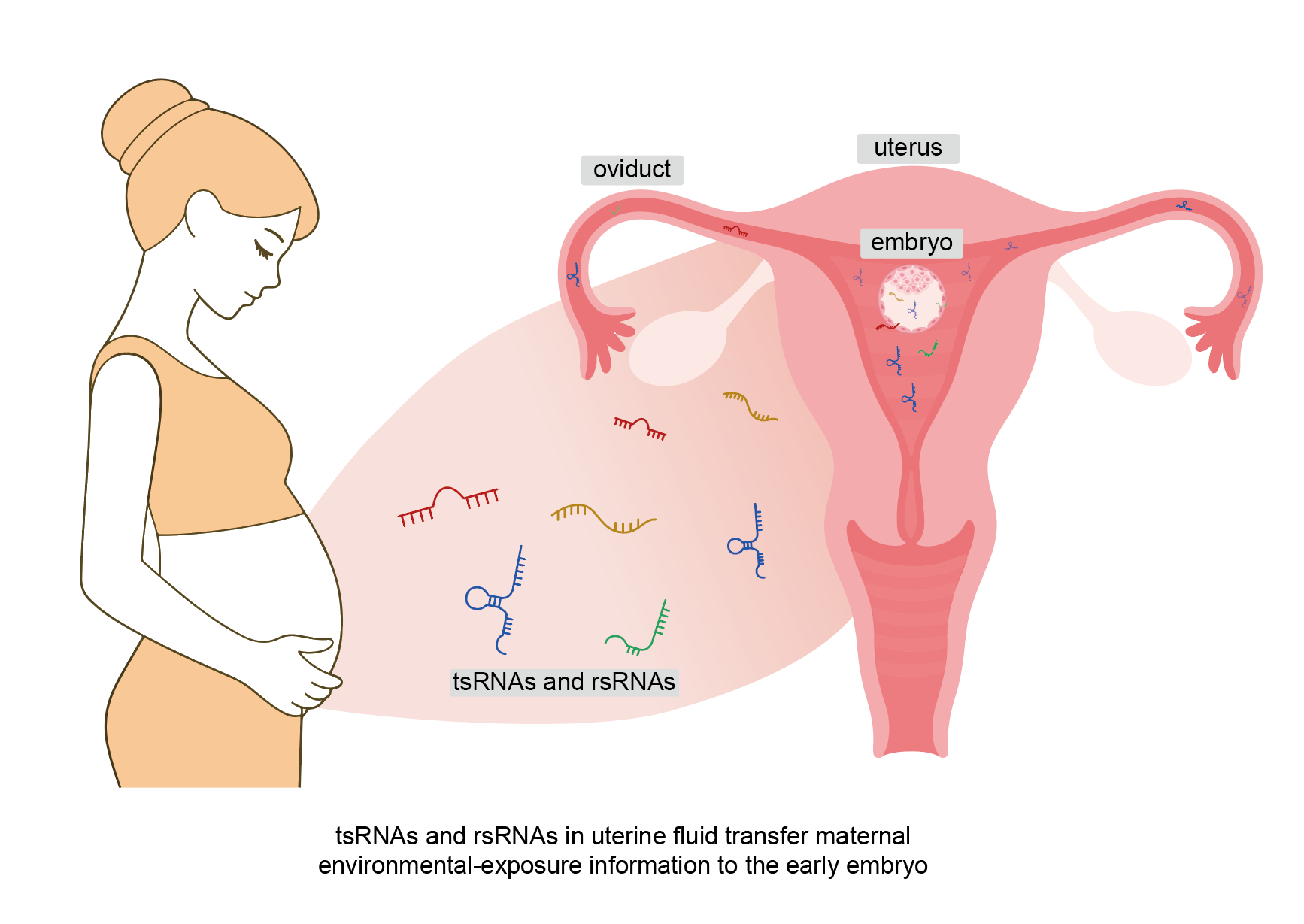
在最新这篇Nature Communications研究中,研究人员利用 PANDORA-seq 系统分析了小鼠胚胎植入前输卵管液和宫腔液中的小 RNA:发现富含 tsRNA 与 rsRNA,且随胚胎发育动态变化;孕早期短期高脂饮食虽不影响囊胚形成率,却重塑了囊胚代谢相关基因表达,导致发育迟缓、宫内生长受限及子代代谢异常;高脂饮食显著改变了宫腔液 tsRNA 与 rsRNA 的表达及修饰谱;关键小 RNA 转染入早期胚胎,可直接模拟高脂饮食引起的基因表达改变。这些结果首次直接证实,孕早期母体环境可通过宫腔液小 RNA 将代谢信号传递至胚胎,进而影响子代健康。
这项研究不仅补齐了配子/生殖道液体小 RNA 机制的母系环节,更为孕早期母体—胚胎通信提供了可操作的研究范式。结合此前的精子 tsRNA 研究,父母双向的小 RNA 信号传递网络雏形已现,也留下了更多需要进一步研究的科学问题,如:孕早期母系小 RNA 信号在 DOHaD 框架中的系统研究;tsRNA/rsRNA 在发育、代谢及疾病风险预测中的功能探索;宫腔液小 RNA 作为孕期健康干预和疾病预防的新靶点等。这些问题的解答将为理解生命早期环境如何影响成年健康以及开发相应的预防和干预策略有深远影响。
北京师范大学生命科学学院博士后潘石甲和国家生物信息中心博士后张力文为本文共同第一作者,北京师范大学生命科学学院张莹、国家生物信息中心侍骏超、山东大学妇儿与生殖健康研究院颜磊为共同通讯作者。
原文链接:https://rdcu.be/eAZ4A