北京师范大学生命科学学院邱小波-姜天霞团队与北京大学生命科学学院高宁-李宁宁团队合作,利用细胞生物学、分子生物学以及生物化学等实验手段揭示了巨型泛素化酶BIRC6/BRUCE(~530 kDa)维持细胞凋亡和自噬间平衡的重要调控机制,并通过冷冻电镜技术解析了BIRC6与促凋亡蛋白Smac/DIABLO的复合物结构。该成果已于2024年1月30日在Nature Communications在线发表,题为“Molecular mechanisms underlying the BIRC6-mediated regulation of apoptosis and autophagy” (Liu et al., Nat Commun, Published online: 30 January 2024, https://doi.org/10.1038/s41467-024-45222-1)。邱小波教授、高宁教授和李宁宁研究员为该文的共同通讯作者,北师大生科院博士生刘硕硕、副教授姜天霞、博士生卜凡、硕士生赵吉兰和博士生王广菲共5人为共同第一作者。其预印本于2022年发表在bioRxiv (Liu et al., 2022, doi: https://doi.org/10.1101/2022.12.10.519866)。 2023年,Science同时发表了三篇其他国际同行关于BIRC6-Smac的复合物冷冻电镜结构,与他们电镜部分的结果完全一致(Hunkeler et al., Science, 2023; Dietz et al., Science, 2023; Ehrmann et al., Science, 2023)。
凋亡是一种复杂且受精密调控的程序性细胞死亡,与个体发育及神经退行性疾病和癌症等各种疾病发生发展密切相关。细胞自噬则是在饥饿、感染等不利应激条件下对蛋白质、损伤细胞器和病原体等降解的过程,与细胞凋亡间存在复杂的相互作用,共同决定细胞命运。在特定条件下,细胞自噬可促进细胞存活,抑制细胞凋亡。因而,揭示这两种途径间的平衡机制至关重要,是对细胞生与死较量机制的诠释。
邱小波教授早在20年前发现BIRC6是一种凋亡抑制蛋白(Inhibitor of Apoptosis Protein, IAP),并且是在迄今发现的8种人类凋亡抑制蛋白中唯一必需的,在凋亡发生时被泛素连接酶(E3)Nrdp1介导的泛素-蛋白酶体途径降解(Qiu et al., EMBO J, 2004)。接着,他和国际同行发现,在正常情况下,BIRC6同时作为泛素耦合酶(E2)和泛素连接酶使促凋亡蛋白Smac和凋亡效应蛋白酶(如caspase-3)泛素化并被蛋白酶体降解,最终抑制细胞凋亡(Qiu et al., JBC, 2005;Bartke et al., Mol Cell, 2005; Hao et al., Nat Cell Biol., 2005)。随后,他的团队又发现BIRC6不仅抑制凋亡,而且在特定应激条件下与Nrdp1、接头蛋白SIP/CacyBP形成复合物,促进自噬关键蛋白LC3-II前体LC3-I的降解,进而抑制细胞自噬(Jiang et al.,PNAS,2019),提示BIRC6可能是细胞凋亡及自噬间平衡的关键调控因子。这些结果得到了国际同行的进一步验证(Jia et al., eLife, 2019; Lian et al., Theranostics, 2019), 但具体调控机制尚不清楚。
最近,邱小波-高宁合作团队发现,BIRC6还可结合凋亡起始蛋白酶procaspase 9。Smac不能抑制BIRC6与procaspase 9的结合,但可抑制BIRC6与促凋亡蛋白酶HtrA2和凋亡效应蛋白酶caspase 3的结合。同时,BIRC6可有效抑制procaspase 9的蛋白酶活性,而对效应蛋白酶caspase 3活性抑制较弱,说明BIRC6主要作用于凋亡通路的上游。而目前已知的其它凋亡抑制蛋白(如c-IAP1),可能主要作用于凋亡通路的下游,即主要抑制下游的效应蛋白酶caspase 3等。这也可能解释为什么在迄今发现的8种人类凋亡抑制蛋白中仅BIRC6为凋亡抑制所必需。为进一步阐明BIRC6的作用机制,他们得到了分辨率为3.6 Å的BIRC6冷冻电镜结构,揭示BIRC6形成一个反向平行的U型二聚体。重要的是,BIRC6与Smac,而不是其它促凋亡蛋白,在正常条件下的细胞内形成相对稳定的复合物结构。经冷冻电镜技术解析发现BIRC6通过BIR结构域、螺旋结构域和CBM32结构域将Smac固定于BIRC6的U型结构中心,可能起到阻止BIRC6与其它促凋亡蛋白,如促凋亡蛋白酶HtrA2和凋亡效应蛋白酶caspase 3,结合的作用。这些结果提示Smac与BIRC6的相互拮抗可能在细胞凋亡调控中起着关键作用。
另一方面,当细胞响应凋亡刺激时,BIRC6与泛素激活酶(E1)UBA6一起促进自噬关键蛋白LC3的K51位点发生泛素化(Jia et al., eLife, 2019)。邱小波-高宁合作团队发现, LC3的K51泛素化抑制自噬, 促进凋亡。BIRC6的二聚化可能阻断其LIR基序与LC3的结合,而可能在凋亡信号刺激下,该区域二聚化解离,使得LIR基序可以结合LC3,导致LC3降解,自噬被抑制。最后,他们利用人工智能软件AlphaFold 预测发现,二聚体BIRC6中阻碍LIR基序结合LC3的区域与BIRC6中BIR结构域结合Smac的位点相重合,从而可能解释为什么BIRC6能在细胞凋亡和自噬平衡中起关键作用。
BIRC6的突变或过表达与各种癌症相关。这项研究结果不仅揭示了BIRC6如何响应不同刺激而调控凋亡与自噬平衡的分子机制,也有助于发现相关疾病的治疗靶点。该研究受到科技部国家重点研发计划项目,国家自然科学基金委员会原创探索计划项目、重点项目等资助。
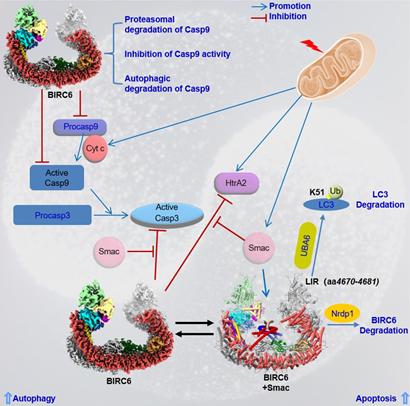
BIRC6平衡细胞凋亡和自噬的分子机制模式图