2024年4月4日,北京师范大学生命科学学院陈苏仁课题组联合上海交通大学附属第九人民医院匡延平课题组、南京医科大学生殖医学国家重点实验室刘明兮课题组在eLife发表了题为Disruption in CYLC1 leads to acrosome detachment, sperm head deformity, and male in/subfertility in humans and mice的研究论文,基于大量男性不育病例和基因敲除/点突变小鼠揭示了精子核周层蛋白Cylicin-1蛋白介导精子顶体锚定,其突变与精子头部畸形密切相关,增进了人们对于精子核周层结构和生理功能的认识,并为男性不育患者的基因诊断、辅助生殖治疗和遗传咨询提供重要参考。

eLife期刊论文评议团队认为这是一项重要的(important)研究,实验证据令人信服(compelling),对于男性生殖领域的科研人员和男科医生具有非常宝贵的(invaluable)参考价值。

精子核周层(Perinuclear theca, PT)是紧紧包裹精子细胞核的一薄层特殊细胞骨架,但其生理功能以及其突变与男性不育的关联并不清楚。陈苏仁课题组近些年来致力于精子核周层结构的研究,利用基因敲除小鼠等手段揭示了精子核周层具有保护精子核和介导顶体锚定等重要生理功能。
精子核周层蛋白Calicin敲除导致顶体下层板的蛋白变化和结构疏松,失去了保护细胞核承受住精子变形过程中塑形力的作用 [1]。随后,上海交通大学附属第九人民医院雷鸣/匡延平/吕祁峰团队和中南大学/中信湘雅生殖与遗传专科医院谭跃球/涂超峰团队分别在精子头部畸形患者中发现多个携带CCIN基因突变的家系[2,3]。《生殖生物学》(Biology of Reproduction)杂志主编、美国科学促进会会士、加州大学洛杉矶分校Wei Yan教授发表专题评论文章,对上述研究给予了高度评价[4]。
精子核周层蛋白ACTRT1通过与顶体内膜蛋白和核膜蛋白相互作用,构建“顶体内膜—顶体下层板—核膜”三明治样结构,负责将发育中的顶体紧紧锚定在精子核膜上[5]。陈苏仁课题组还与重庆医科大学附妇女儿童医院黄国宁/林婷婷课题组合作对120例精子头部畸形症患者并开展了全外显子测序,发现两个ACTRT1基因完全缺失的家系,揭示了ACTRT1基因缺失是人精子顶体脱落和受精失败的致病遗传因素之一[6]。
Cylicin-1蛋白为睾丸特异性表达,定位于精子核周层。研究人员首先利用CRISPR/Cas9基因编辑技术构建了Cylc1基因敲除模型。Cylc1基因敲除小鼠雄性生育力显著降低,精子头部形态异常,透射电子显微镜可观察到顶体与精子核膜脱离,提示Cylicin-1蛋白具有介导顶体锚定的生理功能(图1)。研究人员继而利用多种蛋白互作研究手段揭示了Cylicin-1与顶体下层板蛋白ACTL7A、顶体内膜蛋白SPACA1、核膜蛋白FAM209相互作用,形成“顶体内膜—顶体下层板—核膜”三明治样结构,将发育中的顶体紧紧锚定在精子核膜上。
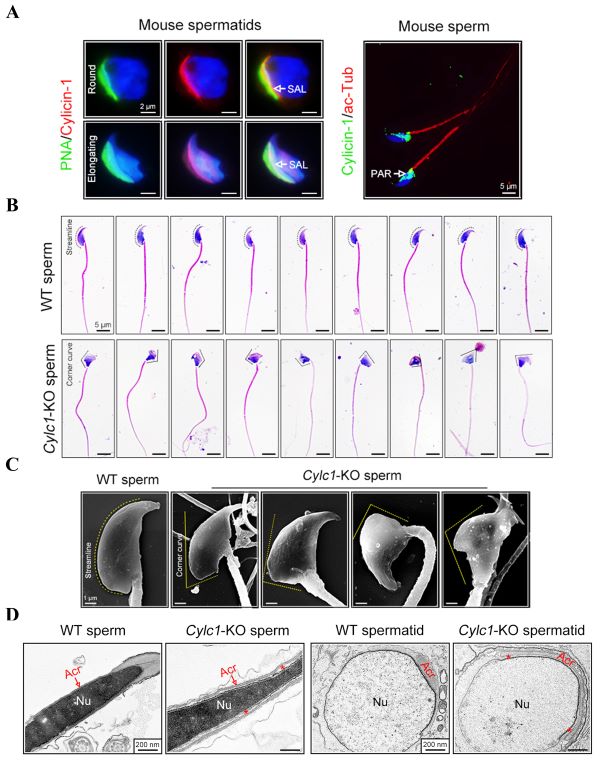
图1. Cylc1基因敲除小鼠精子顶体脱落、头部形态异常
研究团队在上海交通大学附属第九人民医院辅助生殖科和江苏省人民医院生殖医学中心收集了500余例精子头部畸形的男性不育病例,通过全外显子测序发现其中19例患者携带CYLC1基因c.1377G>T/p.K459N半合子突变,该变异位点在物种(人、猩猩、牛、马、啮齿类动物)间高度保守,gnomAD数据库检索发现该变异在人群中较为罕见,SIFT和Polyphen-2等软件预测其可能为有害突变(图2)。
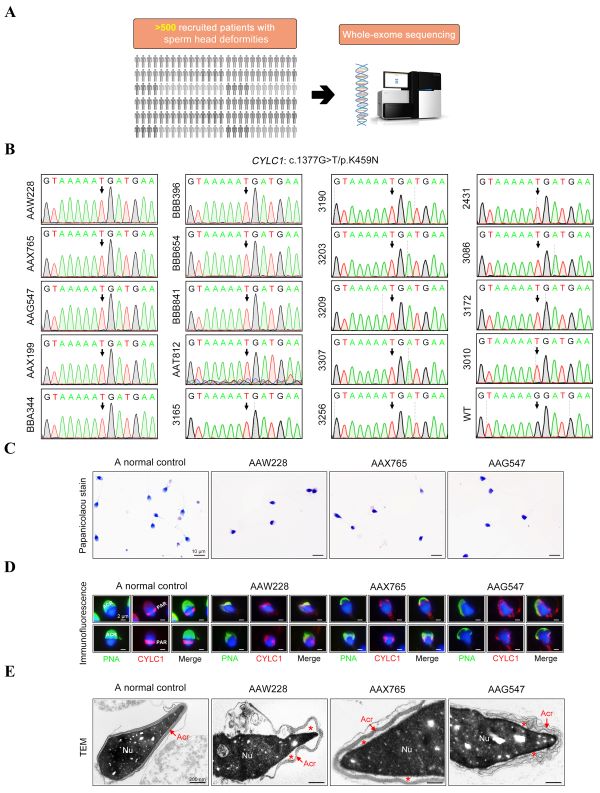
图2. 19例精子头部畸形症患者携带CYLC1基因变异
为了证明CYLC1基因该位点的变异与精子头部畸形的关联,研究人员继而构建了Cylc1基因点突变小鼠。与Cylc1基因敲除小鼠相似,Cylc1基因点突变小鼠雄性生育力显著降低,精子头部形态异常,顶体脱离于精子核膜。该位点变异削弱了Cylicin-1蛋白与顶体下层板蛋白ACTL7A、顶体内膜蛋白SPACA1间的相互作用,从而影响其介导的顶体锚定(图3)。
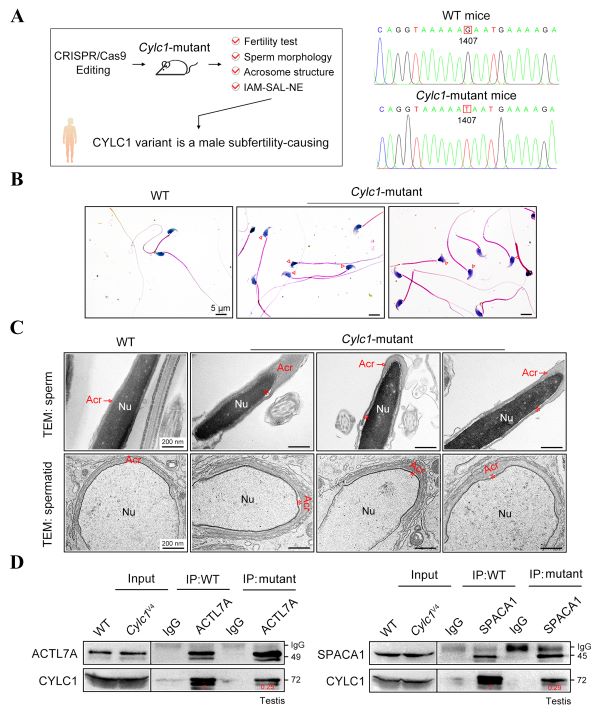
图3. 点突变影响Cylicin-1蛋白介导的精子顶体锚定功能
该篇文章还报道了17名CYLC1基因变异患者的辅助生殖结局:其中8名患者夫妻首个周期选择了体外受精—胚胎移植(IVF-ET,俗称“一代试管”)失败,继而尝试了卵胞浆内单精子注射(ICSI,俗称“二代试管”)单独或联合卵子人工激活(AOA),最终5人怀孕并诞下健康婴儿;另外9名患者夫妻直接选择ICSI单独或联合AOA,均获得了优质胚胎可供移植,最终8人怀孕并诞下健康婴儿。根据17名CYLC1基因变异患者的辅助生殖结局,研究人员认为ICSI单独或联合AOA可能是治疗CYLC1基因变异导致男性不育的有效辅助生殖手段。
综上所述,本项研究利用Cylc1基因敲除小鼠揭示了精子核周层蛋白Cylicin-1介导顶体锚定的生理功能;更为有临床意义的是,这项研究从大量精子头部畸形的男性不育患者中鉴定到CYCL1基因突变,并通过Cylc1基因点突变小鼠验证了该位点变异对Cylicin-1介导精子顶体锚定的影响(图4)。本研究丰富了人们对精子核周层结构和功能的认识,为精子头部畸形症患者的基因诊断提供了重要靶标,并服务了患者的辅助生殖治疗和遗传咨询。
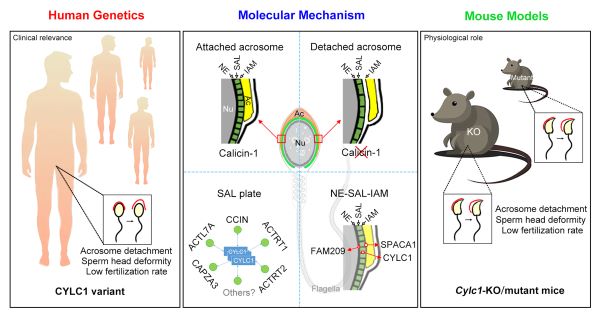
图4. 本研究的模式图
该研究受到国家自然科学基金(32370905)、细胞增殖及调控生物学教育部重点实验室开放基金等资助。
原文链接:
https://elifesciences.org/articles/95054
参考文献:
1. Zhang XZ, Wei LL, Jin HJ, Zhang XH, Chen SR. The perinuclear theca protein Calicin helps shape the sperm head and maintain the nuclear structure in mice. Cell Rep. 2022; 40(1):111049.
2. Fan Y, Huang C, Chen J, Chen Y, Wang Y, Yan Z, Yu W, Wu H, Yang Y, Nie L, Huang S, Wang F, Wang H, Hua Y, Lyu Q, Kuang Y, Lei M. Mutations in CCIN cause teratozoospermia and male infertility. Sci Bull. 2022; 67(20):2112-2123.
3. He J, Liu Q, Wang W, Su L, Meng L, Tan C, Zhang H, Zhang Q, Lu G, Du J, Lin G, Tu C, Tan YQ. Novel homozygous variant of CCIN causes male infertility owing to the abnormal sperm head with a nuclear subsidence phenotype. Clin Genet. 2023; 103(4):495-497.
4. Yan W. Calicin is a key sperm head-shaping factor essential for male fertility. Sci Bull. 2022; 67(23):2395-2397.
5. Zhang XZ, Wei LL, Zhang XH, Jin HJ, Chen SR. Loss of perinuclear theca ACTRT1 causes acrosome detachment and severe male subfertility in mice. Development. 2022; 149(12):dev200489.
6. Zhang Q, Jin H, Long S, Tang X, Li J, Liu W, Han W, Liao H, Fu T, Huang G, Chen S, Lin T. Deletion of ACTRT1 is associated with male infertility as sperm acrosomal ultrastructural defects and fertilization failure in human. Hum Reprod. 2024 Feb 27:deae031.