2025年10月21日,北京师范大学生命科学学院陈苏仁教授课题组联合中国科学院生物物理研究所孙飞/朱赟课题组等多家科研团队在PLOS Biology(中科院1区Top)发表了题为The core outer junction protein CFAP77 connects A- and B-tubules within doublet microtubules of cilia and flagella的研究论文(Research article),该研究将基因敲除小鼠模型与原位结构生物学交叉融合,发现CFAP77为介导纤毛/鞭毛轴丝外周二联体微管中A管与B管连接的核心蛋白,解析了CFAP77缺失导致CFAP77-CCDC105-TEX43三元复合体的丢失、A-B管在外侧连接点处断裂、纤毛/鞭毛运动缺陷。该项研究瞄准基础科学问题,解答了长期困扰纤毛/鞭毛研究领域的一个关键问题——纤毛/鞭毛轴丝外周二联体微管中A-B管究竟是如何连接的。
纤毛(Cilia)是一种特殊的细胞器或称细胞结构,一般指上皮细胞游离面伸出的毛发样突起。纤毛不但在单细胞真核生物(如四膜虫、衣藻等)中参与运动等过程,而且在多细胞真核生物体内广泛存在,几乎遍布所有类型的细胞。纤毛大体可分为运动纤毛(Motile cilia)和初级纤毛(Primary cilia)。运动纤毛具有定向摆动的能力,能够推动自身或周围液体的运动。初级纤毛主要作为感应细胞器,表面分布着许多跨膜受体,被称为是细胞的“天线”,能够感知和传递生长发育所需的信号。
人体中,纤毛具有多种重要的生理功能,如胚胎期节纤毛调控内脏左右位置、脑室管膜纤毛摆动促进脑脊液循环、呼吸道上皮细胞的纤毛能够推动黏液移向咽部并通过咳嗽排出、精子鞭毛负责精子的运动等。纤毛功能障碍往往会导致全身性疾病,统称纤毛病(Ciliopathy),发病率高达1/1000,包括嗅觉丧失、听觉丧失、视网膜退化、雄性不育、脑积水、骨骼畸形、多指、多囊肾、多囊肝、内脏位置左右颠倒等多种症状。因此,研究纤毛的发育及其调控机理不但将揭示人体细胞的诸多生理奥秘,而且对于纤毛病的诊断与潜在治疗有重要价值。
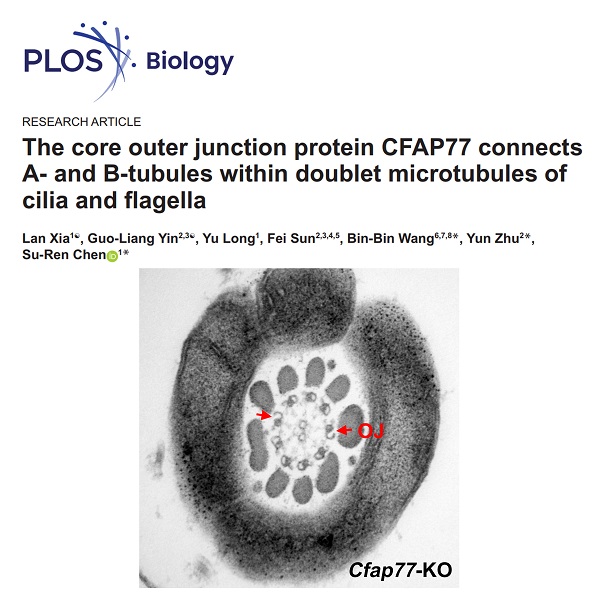
纤毛/鞭毛的运动和感知功能都与其独特的结构密切相关。纤毛和鞭毛的核心结构基本一致,它们实质上都是微管及相关蛋白组建成的轴丝(Axoneme)。运动纤毛的轴丝由外周9组二联体微管(Doublet microtubules, DMTs)和2根中央微管(Central pair, CP)形成,通常称为“9+2”结构。DMTs由A管和B管组成,其中A管为完全微管,由13根原纤丝环绕而成。B管为不完全微管,仅由10根原纤丝构成,另3根原纤丝与A管共用。连接在DMTs上的内动力蛋白臂(Inner dynein arms, IDAs)和外侧动力蛋白臂(Outer dynein arms, ODAs)作为马达蛋白复合体,为纤毛运动提供驱动力。除动力蛋白臂之外的一些蛋白复合体参与轴丝运动的调节,例如位于CP和DMTs之间的放射辐(Radial spoke, RS)、位于相邻DMTs间的连接蛋白-动力蛋白调节复合物(Nexin-dynein regulatory complex,N-DRC)等(图1A,B)。初级纤毛没有CP和动力蛋白臂,不能运动,结构上属于“9+0”模式。
DMTs中A管与B管存在两个连接位点,分别称为外侧连接点(Outer junction, OJ)和内侧连接点(Inner junction, IJ)。OJ位于A11-A12和B01-B02原纤丝附近的微管内,IJ则位于A01和B10原纤丝之间(图1C)。A管与B管的紧密连接对于维持DMTs稳定性发挥至关重要的作用,如若DMT-B管发生开放则会影响各种轴丝附属结构的附着或它们功能的协调。纤毛轴丝DMTs结构中A管与B管连接的组成蛋白和调控机制一直是纤毛研究领域的关键科学问题之一,对于理解轴丝结构、纤毛功能及其纤毛病发病机理有重要价值。
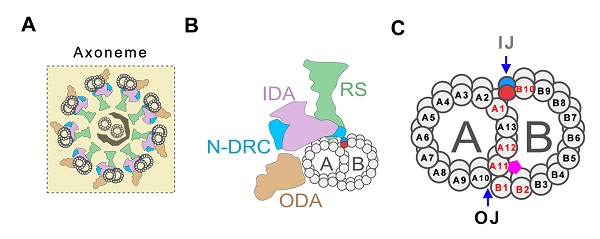
图1. 纤毛/鞭毛轴丝结构及DMTs中A-B管连接
合作团队前期利用原位冷冻断层扫描技术(cryo-ET)结合人工智能(AI)解析了哺乳动物精子轴丝DMTs的高分辨率原位结构 [1],发现CFAP77是物种间保守的OJ核心组成蛋白,结合A11-A12和B01-B02原纤丝。除了CFAP77之外,CCDC105和TEX43也被发现定位于OJ部位,结合A11-A12原纤丝,但这两者仅存在于精子鞭毛而不表达于其他类型的纤毛。基于原位结构生物学发现,合作团队提出了一种假说:CCDC105细丝束将CFAP77单体串联起来,形成更加稳固的OJ结构,发挥连接DMT-A管与B管的功能,TEX43位于相邻两个CCDC105分子的交接位置,推测可进一步加强CCDC105单体间的相连(图2)。
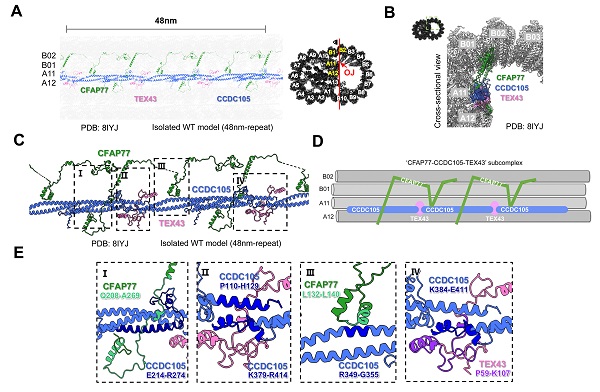
图2. OJ结构蛋白复合体CFAP77-CCDC105-TEX43
陈苏仁教授实验室继而构建了Cfap77基因敲除小鼠。Cfap77-KO小鼠雄性不育,精子数量和形态基本正常,但精子运动存在明显的缺陷(图3A)。透射电镜发现Cfap77-KO小鼠精子轴丝中约45%的DMT-B管存在明显的开放现象(图3B)。蛋白表达和功能完美对应,充分证明了CFAP77蛋白的确发挥着维持DMTs中A-B管在OJ部位连接的关键生物学功能。为了揭示CFAP77蛋白缺失导致DMT-B管开放的结构与分子机制,陈苏仁教授实验室与中国科学院生物物理研究所孙飞/朱赟研究员团队合作,利用cryo-ET+AI技术成功解析了Cfap77-KO小鼠精子轴丝DMTs的原位结构(分辨率为24 Å)。可以清楚地观察到,CFAP77敲除导致CFAP77-CCDC105-TEX43三元蛋白复合体在DMT-OJ部位丢失(图3C),从而引起DMT-B管在OJ部位的开放和精子运动功能缺陷(图3D)。
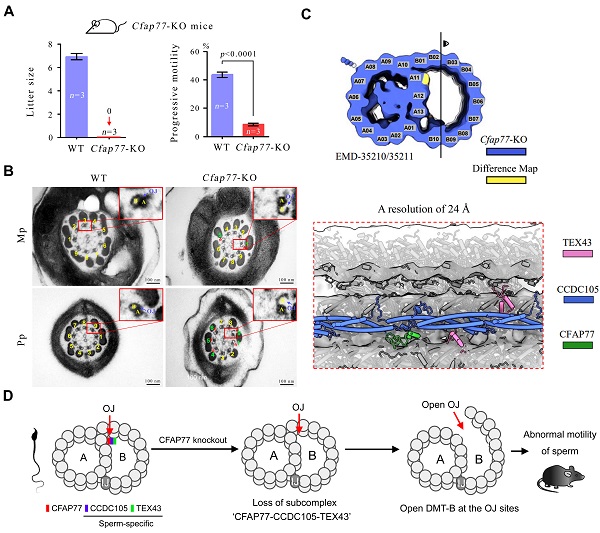
图3. CFAP77敲除导致CFAP77-CCDC105-TEX43三元复合体丢失和DMT-B管开放
理念与技术突破——基因编辑小鼠模型与原位结构生物学的交叉融合
纤毛/鞭毛轴丝研究领域存在如下两大瓶颈:(1)由于解析轴丝超微结构研究手段的局限性,虽然历经几十年的科学研究,人们对于轴丝精密结构的认识还十分欠缺,许多结构蛋白尚未被鉴定,其生理功能仍未可知;(2)由于传统细胞、分子、生化、多组学和透射电镜技术在研究尺度方面的局限性,多数纤毛病致病基因的变异导致轴丝结构与纤毛功能缺陷背后的分子机制并不清楚。
近几年,结构生物学对纤毛/鞭毛轴丝超微结构的解析将人们对轴丝这台精密仪器的认识带到了近原子分辨率水平。原位结构生物学不仅可以解析轴丝的“全景式”、近原子分辨率的超微结构,鉴定出新的轴丝结构蛋白,而且将原位结构生物学与基因编辑小鼠模型相结合可以实现对基因变异导致轴丝超微结构改变的原位、可视化观察,在揭示致病机理方面具有十分突出的优势,显著拓展了纤毛/鞭毛轴丝研究的广度与深度。
2025年8月,陈苏仁教授课题组与中国科学院生物物理研究所孙飞/朱赟团队合作利用cryo-ET技术首次成功解析了哺乳动物(小鼠)精子鞭毛轴丝的中央微管(CP)的原位结构(5.5-18 Å),极大丰富了我们对轴丝CP蛋白组成与组装的认识,研究成果发表在Cell Research杂志上[2]。文章发表以来受到了广泛关注,获得加拿大麦吉尔大学(McGill University)Khanh Huy Bui等专家的专题点评,认为这是一项开创性工作,被中国科学报和BioArt(清华大学隋森芳院士、中国科学院生物化学与细胞生物学研究所朱学良教授专题点评)等多家媒体报道与评论。
该篇PLOS Biology文章中研究团队解析了Cfap77-KO小鼠精子鞭毛轴丝DMTs的原位结构(24 Å),直接观察到OJ部位CFAP77-CCDC105-TEX43三元复合体丢失,从而揭示了OJ核心蛋白CFAP77敲除导致DMT-B管开放的结构与分子机制。基因编辑小鼠模型与原位结构生物学的交叉融合具有可行性与创新性,两者的结合优势突出,是未来相关研究的前沿方向之一。
该研究受到国家自然科学基金面上项目(32571005)和细胞增殖及调控生物学教育部重点实验室开放基金等资助,北京师范大学为第一完成单位,陈苏仁教授为最后通讯作者,实验室夏兰博士研究生(在读)为论文共同第一作者(第一位)。
原文连接:
https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3003442
参考文献:
1. Tai L. Yin G, Huang X, Sun F, Zhu Y. (2023) In-cell structural insight into the stability of sperm microtubule doublet. Cell Discovery. 9,116.
2. Zhu Y, Lin T, Yin G, Tai L, Chen L, Ma J, Huang G, Lu Y, Zhang Z, Wang B, Chen S, Sun F. (2025) In situ structure of the mouse sperm central apparatus reveals mechanistic insights into asthenozoospermia. Cell Research. 35(8):551-567.
3. Legal T, Bui KH. (2025) Bridging the gap: how sperm's core structure explains male infertility. Cell Research. 35(9):617-618.